Биотехи. Часть 1
25 сентября 2020
Отказ от ответственности. У меня нет профессионального образования ни в медицине, ни в биологии, поэтому всё написанное ниже следует воспринимать с поправкой на дилетантство и долей сомнений. Данная статья представляет собой первую из трёх статей по биотехнологическим компаниям.
Биотехническая компания — компания, занимающаяся разработкой лекарственных средств. Из компаний США, по моим наблюдениям, разработчики в своей массе профанируют деятельность. То есть заявляют о какой-нибудь «прорывной» молекуле-ингибиторе, поднимают под это дело финансирование с рынка, а потом в течении 2-5 лет проводят клинические исследования. При этом понимают слабость модели, низкую эффективность или вовсе занимаются разработкой не самостоятельно, а через посредников. Как следствие, проваливают исследования (эффективность не превосходит плацебо) и дальше компания либо станет пытаться применить лекарство по другим болезням, либо начнёт искать новую молекулу. Зачастую у биотехов параллельно есть запасные варианты молекул, на которые можно переключить внимание инвесторов в случае провала основного препарата. И так на протяжении десятков лет с периодическим изменением названий компаний, тикеров и размытием капитала в сотни раз. Цель разработчиков — продержаться на бирже как можно дольше, получая с рынка лёгкие деньги. Я не пытаюсь напугать читателя, настоящие разработчики с прорывными разработками тут тоже есть, но их значительно меньше и ещё меньше тех, которые стоят адекватно рыночной перспективе.
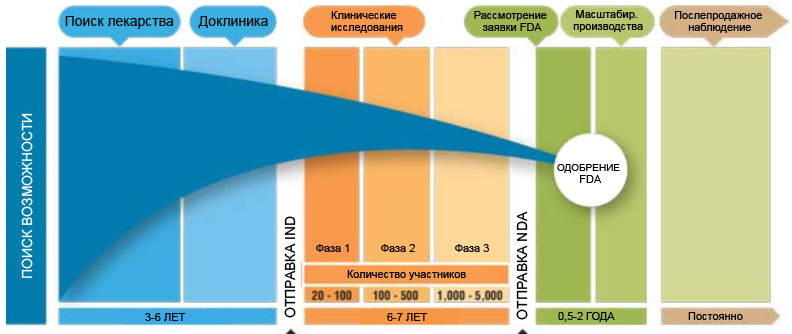
Цикл разработки лекарств делится на следующие этапы:
Поиск молекулы выполняется с участием исследований "In vitro" (исследования в стекле, вне живых организмов: в чашках Петри, пробирках и тому подобном).
Процесс поиска монотонен и периодически всплывают статьи об автоматизации этого дела с помощью роботов. Вот видео с примером работы последнего:
https://www.youtube.com/watch?v=MjfTDrnPiWc
Мыши удобны тем, что быстро размножаются, неприхотливы, подручны и маленькие. Но мышей используют не полевых, а специальных - из чистых линий. Смысл чистых линий в том, что эти животные идентичны генетически. От отца и матери получатся точно такие же однородные потомки. Это позволяет исключить влияние генетического разнообразия в исследованиях. Например, если в одном исследовании будут использовать мышей-эКтоморфов (худых, т.к метаболизм ускорен), а в другом станут использовать мышей- эНдоморфов (толстых, т.к метаболизм замедлен), то результаты в двух исследованиях будут разными. Поэтому, что бы не было чехарды и непоняток, используют чистые линии, а в научных статьях указывают какая конкретная линия мышей использовалась при том или ином исследовании. К слову, по мере старения метаболизм (обмен веществ) замедляется и поэтому с возрастом происходит набор веса.
Сложнее пероральные способы - таблетки и гранулы. Например, если у человека язвы в желудке, то таблетка должна раствориться и высвободить молекулы (действующее вещество) точно в желудке. А если язвы в тонком кишечнике, то молекулы должны высвободится в тонком кишечнике. Но что делать, если длина тонкого кишечника 7 метров? На это есть действие с пролонгацией - когда таблетка растворяется и высвобождает действующее вещество на протяжении всей тонкой кишки по мере движения каловых масс. Достигается это под действием определённой Ph-среды. Когда нужно объёмное действие, то используют гранулы. Гранулы это песочнообразные мелкие шарики, которые в сумме дают большую площадь соприкосновения. При язвах эта форма более эффективна, но и дорога.

Особо важный момент в том, что лекарственная сущность не должна быть токсичной. Представьте, что лекарство показало феноменальную терапевтическую способность, но через 8 лет выясняется, что оно способствует новообразованиям. Это не означает, что лекарство не будет одобрено и допушено к продаже, но вносит определённую неопередёлннность. Широкий спект побочек, например, характерен для иммунных препаратов, так как их польза превосходит вред.
Часть по доставке написана очень поверхностно и она затрагивает лишь начальный жизненный цикл лекарственного вещества в организме. Если смотреть шире, то жизненный цикл лекарства в организме состоит из всасывания, распределения, метаболизма и выведения. Важно же не только доставить, но и что бы действие лекарства продолжалось заданное время и потом вещество спокойно вывелось.
Заявка IND регламентируется и должна включать результаты доклинических испытаний, аналитику, литературные источники (научные статьи), состав и способы производства вещества, предлагаемый клинический протокол. Основное внимание в IND уделяется плану и протоколам проведения исследований на людях. IND автоматически вступает в силу через 30 дней после поступления этой заявки в FDA, если, конечно, у FDA не возникнут вопросы.
Клинические исследования делятся на 3 фазы. Переход к каждой из последующих фаз возможен только при успешном завершении предыдущей файзы. Исследования публикуются на портале https://clinicaltrials.gov/
В фазах чётко заявляется количество участников, первичные и вторичные конечные точки, которые лекарство стремится достигнуть. Важно отметить, что исследование считается успешным, если достижение точек произошло со статистической значимостью по сравнению с плацебо и если такое имеет место быть, то по сравнению с другим сравниваемым препаратом. Исследование слепое, то есть пациент не знает что он получает - реальное лекарство или пустышку. Кроме этого, лекарство должно придерживаться профиля безопасности. Например, 3 сентября 2020 года компания Akebia Therapeutics (NASDAQ:AKBA) опубликовала результаты тестирования фазы 3 (ссылка https://ir.akebia.com/news-releases/news-release-details/akebia-therapeutics-announces-top-line-results-its-pro2tect), которое показало не достижения профиля безопасности тестируемого лекарственного препарата и котировки упали с 10$ до 2,65$.
Рассмотрим фазы тестирования:
Фаза 1 - оценка безопасности. На этой фазе препарат вводят 20-30 здоровым добровольцам, которые за это получают оплату. На первой фазе важно оценить побочные действия, распределение, содержание в плазме и вывод вещества из организма. Иногда фаза 1 может одновременно являться фазой 2а. Это имеет смысл для случаев, когда использование здоровых добровольцев лишено смысла. Например, компания Histogen (NASDAQ:HSTO) занимается разработкой средства для стимуляции роста волос на голове и проводит фазу исследования 1/2а.
Фаза 2 - оценка эффективности и подбор дозы. Фаза может делится на два вида - 2a и 2b.
Фаза 2a включает 30-50 больных участников, разделённых на несколько групп. Одной из групп дают плацебо (пустышку, вещество без лекарственной активности), а другим дают вещество с разными дозами, например, 50, 100 и 500 миллиграммов. Группе плацебо иногда могут давать не чисто одни плацебо, а делить дозу на две части - в одно плацебо, а в другой лекарство.
Эффектиность оценивают по формуле = Эффективность в группе лекарства - Эффективность в группе плацебо. Например, если в группе плацебо эффектиность = 16%. А в группе лекарства = 63%. Итоговая эффектиность = 63 - 16 = 47%.
Дозу подбирают не случайно, т.к бывает, что 100 мг эффективнее 500 мг.
Фаза 2b включает 200-300 больных участников. Тут тоже могут проводить исследование на нескольких группах с выбором оптимальных доз лекарства.
Фаза 3 чаще включает более тысячи больных участников, но может иметь меньшее количество участников. Например, у компании Seres Therapeutics Inc (NASDAQ:MCRB) в исследовании фазы 3 заявлено 225 участников. Ссылка на страницу исследования https://clinicaltrials.gov/ct2/show/NCT03183141?term=seres&draw=2&rank=1
По времени:
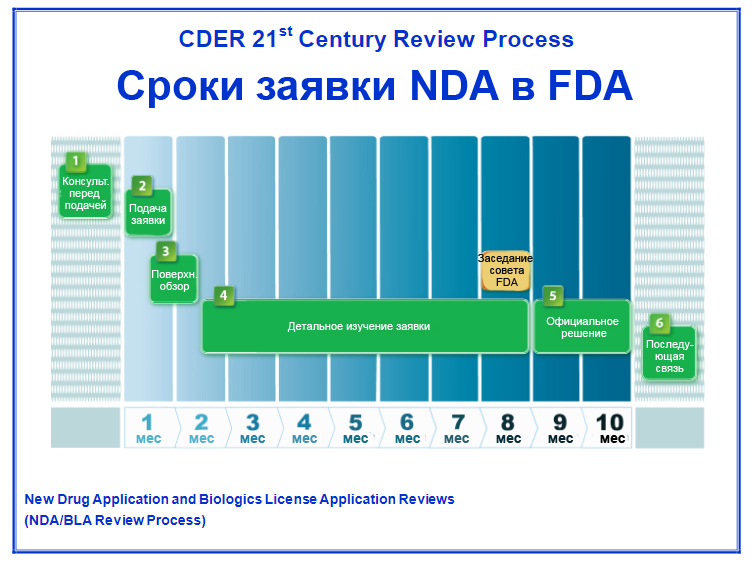
FDA в течении 10 месяцев изучает и оценивает заявку NDA. Факт успешного прохождения клинических исследований не ведёт к 100% одобрению заявки управлением FDA. Например, FDA завернуло французскую DBV Technologies (NASDAQ:DBVT) с их пластырем для лечения аллергии на арахис у детей в возрасте от 4 до 11 лет. В письме компании FDA указывает, что были выявлены проблемы с влиянием сцепления (адгезии) пластыря на эффективность и указали на необходимость изменения пластыря, а затем проведения новых исследований.
После одобрения заявки NDA компания, как правило, выстреливает и на этом инвестиционно-спекулятивная история заканчивается.
Биотехническая компания — компания, занимающаяся разработкой лекарственных средств. Из компаний США, по моим наблюдениям, разработчики в своей массе профанируют деятельность. То есть заявляют о какой-нибудь «прорывной» молекуле-ингибиторе, поднимают под это дело финансирование с рынка, а потом в течении 2-5 лет проводят клинические исследования. При этом понимают слабость модели, низкую эффективность или вовсе занимаются разработкой не самостоятельно, а через посредников. Как следствие, проваливают исследования (эффективность не превосходит плацебо) и дальше компания либо станет пытаться применить лекарство по другим болезням, либо начнёт искать новую молекулу. Зачастую у биотехов параллельно есть запасные варианты молекул, на которые можно переключить внимание инвесторов в случае провала основного препарата. И так на протяжении десятков лет с периодическим изменением названий компаний, тикеров и размытием капитала в сотни раз. Цель разработчиков — продержаться на бирже как можно дольше, получая с рынка лёгкие деньги. Я не пытаюсь напугать читателя, настоящие разработчики с прорывными разработками тут тоже есть, но их значительно меньше и ещё меньше тех, которые стоят адекватно рыночной перспективе.
Цикл разработки лекарств делится на следующие этапы:
1) Поиск лекарственной сущности
Наиболее часто под сущностью (химическим соединением) понимается малая молекула, способная вызывать биологическую реакцию клетки. Для простоты тут и далее вместо химического соединения я буду использовать термин Молекула, но не всегда лекарственное средство это малая молекула. Вирусы, например, это молекулы ДНК или РНК, заключенные в белковую оболочку. На основе вирусов работают вакцины и терапевтические средства по лечению генных заболеваний.Поиск молекулы выполняется с участием исследований "In vitro" (исследования в стекле, вне живых организмов: в чашках Петри, пробирках и тому подобном).
Процесс поиска монотонен и периодически всплывают статьи об автоматизации этого дела с помощью роботов. Вот видео с примером работы последнего:
https://www.youtube.com/watch?v=MjfTDrnPiWc
2) Доклинические исследования
Когда теоретическая молекула найдена, далее выполняются исследования "In vivo" (на живом организме). Такие исследования называются исследованиями на животной модели. В качестве животных чаще используют определённые чистые линии мышей. Возможно, кто-то спросит: "А причём тут лекарства для человека и мыши?" Дело в том, что у всех позвоночных когда-то в древности был общий предок, но в процессе эволюции организмы видоизменились, приспособились какждый к своим условиям и получилось такое широкое разнообразие: от ежа до человека. Но если визуально мы изменились сильно, то на клеточном уровне и строении органов различия не так сильны. У всех так же есть мозг, лёгкие, почки, желчный пузырь, сердце, все так же испражняются. И точно так же что будет полезно или вредно для мышей, с высокой долей вероятности будет полезно или вредно для человека.
Мыши удобны тем, что быстро размножаются, неприхотливы, подручны и маленькие. Но мышей используют не полевых, а специальных - из чистых линий. Смысл чистых линий в том, что эти животные идентичны генетически. От отца и матери получатся точно такие же однородные потомки. Это позволяет исключить влияние генетического разнообразия в исследованиях. Например, если в одном исследовании будут использовать мышей-эКтоморфов (худых, т.к метаболизм ускорен), а в другом станут использовать мышей- эНдоморфов (толстых, т.к метаболизм замедлен), то результаты в двух исследованиях будут разными. Поэтому, что бы не было чехарды и непоняток, используют чистые линии, а в научных статьях указывают какая конкретная линия мышей использовалась при том или ином исследовании. К слову, по мере старения метаболизм (обмен веществ) замедляется и поэтому с возрастом происходит набор веса.
3) Выбор формы доставки
Молекулу нужно доставить к целевому участку организма. При этом необходимо, что бы молекула дошла целёхонькой и невредимой. С клизмами и суппозиториями (свечками) более-менее понятно - это локальная доставка к конкретному месту: вагинальный отдел, нисходящий отдел толстой кишки, прямая киша. В случае инъекций это тоже относительно доступный способ доставки.Сложнее пероральные способы - таблетки и гранулы. Например, если у человека язвы в желудке, то таблетка должна раствориться и высвободить молекулы (действующее вещество) точно в желудке. А если язвы в тонком кишечнике, то молекулы должны высвободится в тонком кишечнике. Но что делать, если длина тонкого кишечника 7 метров? На это есть действие с пролонгацией - когда таблетка растворяется и высвобождает действующее вещество на протяжении всей тонкой кишки по мере движения каловых масс. Достигается это под действием определённой Ph-среды. Когда нужно объёмное действие, то используют гранулы. Гранулы это песочнообразные мелкие шарики, которые в сумме дают большую площадь соприкосновения. При язвах эта форма более эффективна, но и дорога.

Особо важный момент в том, что лекарственная сущность не должна быть токсичной. Представьте, что лекарство показало феноменальную терапевтическую способность, но через 8 лет выясняется, что оно способствует новообразованиям. Это не означает, что лекарство не будет одобрено и допушено к продаже, но вносит определённую неопередёлннность. Широкий спект побочек, например, характерен для иммунных препаратов, так как их польза превосходит вред.
Часть по доставке написана очень поверхностно и она затрагивает лишь начальный жизненный цикл лекарственного вещества в организме. Если смотреть шире, то жизненный цикл лекарства в организме состоит из всасывания, распределения, метаболизма и выведения. Важно же не только доставить, но и что бы действие лекарства продолжалось заданное время и потом вещество спокойно вывелось.
4) Подача заявки IND
Когда определились с молекулой (действующим веществом) и формой доставки компания в США подаёт заявку "Новое исследуемое лекарство" (IND, Investigational New Drug) в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA, Food and Drug Administration) для получения разрешения на проведения клинических исследований на людях.Заявка IND регламентируется и должна включать результаты доклинических испытаний, аналитику, литературные источники (научные статьи), состав и способы производства вещества, предлагаемый клинический протокол. Основное внимание в IND уделяется плану и протоколам проведения исследований на людях. IND автоматически вступает в силу через 30 дней после поступления этой заявки в FDA, если, конечно, у FDA не возникнут вопросы.
5) Клинические исследования
Ппереход к больницам и живым людям. Для исключения манипуляций применение лекарств выполняется врачами-исследователями в больницах, не связанных с компанией-производителем. По мере роста количества участвующих пациентов, растёт и число больниц. Как правило исследования имеют международный характер. Например, компания Abivax (тикер на парижской бирже ABVX) проводит фазу 2а для лечения Ревматоидного артрита на 60 участниках в следующих странах: Бельгия, Чехия, Франция, Венгрия, Польша. Ссылка на исследование https://clinicaltrials.gov/ct2/show/NCT03813199?term=abivax&draw=2&rank=2Клинические исследования делятся на 3 фазы. Переход к каждой из последующих фаз возможен только при успешном завершении предыдущей файзы. Исследования публикуются на портале https://clinicaltrials.gov/
В фазах чётко заявляется количество участников, первичные и вторичные конечные точки, которые лекарство стремится достигнуть. Важно отметить, что исследование считается успешным, если достижение точек произошло со статистической значимостью по сравнению с плацебо и если такое имеет место быть, то по сравнению с другим сравниваемым препаратом. Исследование слепое, то есть пациент не знает что он получает - реальное лекарство или пустышку. Кроме этого, лекарство должно придерживаться профиля безопасности. Например, 3 сентября 2020 года компания Akebia Therapeutics (NASDAQ:AKBA) опубликовала результаты тестирования фазы 3 (ссылка https://ir.akebia.com/news-releases/news-release-details/akebia-therapeutics-announces-top-line-results-its-pro2tect), которое показало не достижения профиля безопасности тестируемого лекарственного препарата и котировки упали с 10$ до 2,65$.
Рассмотрим фазы тестирования:

Фаза 1 - оценка безопасности. На этой фазе препарат вводят 20-30 здоровым добровольцам, которые за это получают оплату. На первой фазе важно оценить побочные действия, распределение, содержание в плазме и вывод вещества из организма. Иногда фаза 1 может одновременно являться фазой 2а. Это имеет смысл для случаев, когда использование здоровых добровольцев лишено смысла. Например, компания Histogen (NASDAQ:HSTO) занимается разработкой средства для стимуляции роста волос на голове и проводит фазу исследования 1/2а.
Фаза 2 - оценка эффективности и подбор дозы. Фаза может делится на два вида - 2a и 2b.
Фаза 2a включает 30-50 больных участников, разделённых на несколько групп. Одной из групп дают плацебо (пустышку, вещество без лекарственной активности), а другим дают вещество с разными дозами, например, 50, 100 и 500 миллиграммов. Группе плацебо иногда могут давать не чисто одни плацебо, а делить дозу на две части - в одно плацебо, а в другой лекарство.
Эффектиность оценивают по формуле = Эффективность в группе лекарства - Эффективность в группе плацебо. Например, если в группе плацебо эффектиность = 16%. А в группе лекарства = 63%. Итоговая эффектиность = 63 - 16 = 47%.
Дозу подбирают не случайно, т.к бывает, что 100 мг эффективнее 500 мг.
Фаза 2b включает 200-300 больных участников. Тут тоже могут проводить исследование на нескольких группах с выбором оптимальных доз лекарства.
Фаза 3 чаще включает более тысячи больных участников, но может иметь меньшее количество участников. Например, у компании Seres Therapeutics Inc (NASDAQ:MCRB) в исследовании фазы 3 заявлено 225 участников. Ссылка на страницу исследования https://clinicaltrials.gov/ct2/show/NCT03183141?term=seres&draw=2&rank=1
По времени:
- Фаза 1 занимает 6-12 месяцев.
- Фаза 2а и 2b занимает 1,5-2 года каждая.
- Фаза 3 занимает 2-3 года.
6) Подача заявки NDA
После успешного завершения исследования фазы 3 компания полгода готовит, а затем подаёт заявку на "Новое лекарственное средство" (NDA, New Drug Application) в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA, Food and Drug Administration) для получения разрешения на продажу лекарства в аптеках.
FDA в течении 10 месяцев изучает и оценивает заявку NDA. Факт успешного прохождения клинических исследований не ведёт к 100% одобрению заявки управлением FDA. Например, FDA завернуло французскую DBV Technologies (NASDAQ:DBVT) с их пластырем для лечения аллергии на арахис у детей в возрасте от 4 до 11 лет. В письме компании FDA указывает, что были выявлены проблемы с влиянием сцепления (адгезии) пластыря на эффективность и указали на необходимость изменения пластыря, а затем проведения новых исследований.
После одобрения заявки NDA компания, как правило, выстреливает и на этом инвестиционно-спекулятивная история заканчивается.