Odonate Therapeutics — мажоритарий скупал акции, но препарат не одобрили
23 сентября 2023
Отказ от ответственности. У меня нет профессионального образования ни в медицине, ни в биологии, поэтому всё написанное ниже следует воспринимать с поправкой на дилетанство и долей сомнений.
Odonate Therapeutics является хорошим примером того, что нельзя слепо доверяться покупкам инсайдеров, даже когда они наращивают мажоритарную долю. Но обо всём по порядку.

Компания Odonate Therapeutics занималась клиническим исследованием препарата Тезетаксел (Tesetaxel) для лечения метастатического рака молочной железы.
Вот что писала компания в своём отчёте 10-K за 2020 год:
Оригинальный текст
Перевод от Яндекса
Строго говоря, что пишет компания к действительности не всегда имеет отношение, так как подчёркиваются и выделяются только положительные моменты, а о негативных сторонах дела умалчивается или завуалируется, что может приводить к потери капитала доверившегося читателя.
Посмотрим на анонс результатов исследования CONTESSA, опубликованные 24 августа 2020 года и которые организация характеризует как положительные:
https://www.businesswire.com/news/home/20200824005197/en/Odonate-Therapeutics-Announces-Positive-Top-line-Results-from-CONTESSA-a-Phase-3-Study-of-Tesetaxel-in-Patients-with-Metastatic-Breast-Cancer
Перевод от Яндекса
Особый кусок из оригинала новости
По новости ясно, что препарат показывает эффективность, но есть сильная побочка - нейтропения 3 и 4-й степени (>=3), возникающая у 71% пациентов и на 60% чаще, чем у другого сравниваемого и одобренного препарата - Капецитабина.
Для упрощения я вставлю кусок короткого, но ёмкого по сути описания нейтропении с сайта
https://oncoguide.ru/poleznye-materialy/309-nejtropeniya-prichiny-profilaktika-opasnost/
На новости 24 августа 2020 года с информацией о положительных результатах исследования и наличии чувствительной побочки в виде нейтропении рынок отреагировал отрицательно, бумага упала на 45%
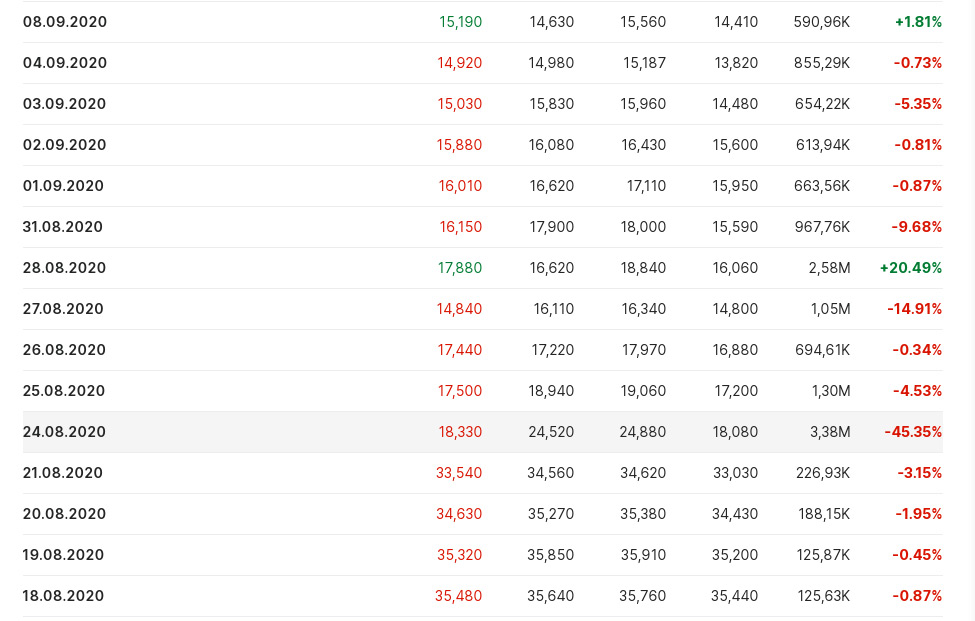
Теперь подходим к инсайдерам. У компании по сведениям из отчёта 10-К за 2019 год был крупный мажоритарий - Кевин Танг (Kevin Tang), владеющий 46% акций. Кевин через свой фонд Tang Capital Management LLC не первый год участвует в жизни биотехнических компаний и поэтому очевидно, что это не случайный человек и имеет значительный опыт. Более того, Кевин в качестве зарплаты назначил себе 1$.
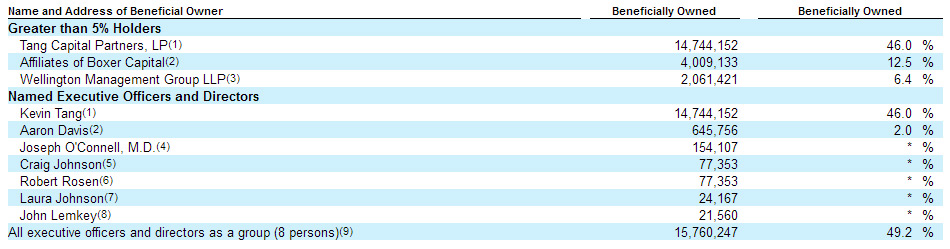
Даже после результатов фазы 3, когда бумага растеряла 50% своей цены Кевин Танг докупал бумаги на чувствительные объёмы
В период с 8 по 11 декабря 2020 года в Сан-Антонио (США) проводилась конференция по раку молочной железы, на которой Odonate Therapeutics представила более полные результаты третьей фазы клинического испытания Тезетаксела и опубликовала презентацию (скачать презентацию — PDF, 673 Кб).
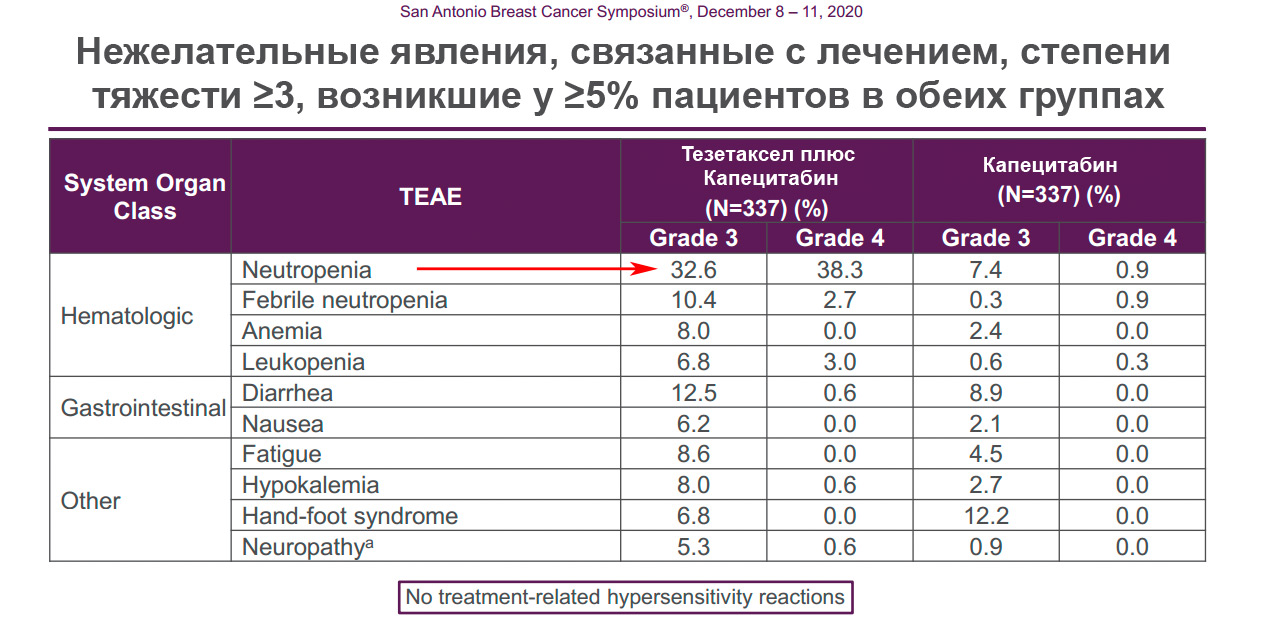
Нам больше всего интересны слайды с нежелательными явлениями (побочками), возникшими при приёме лекарства
В презентации 76% случаев нейтропении относятся ко всем степеням тяжести
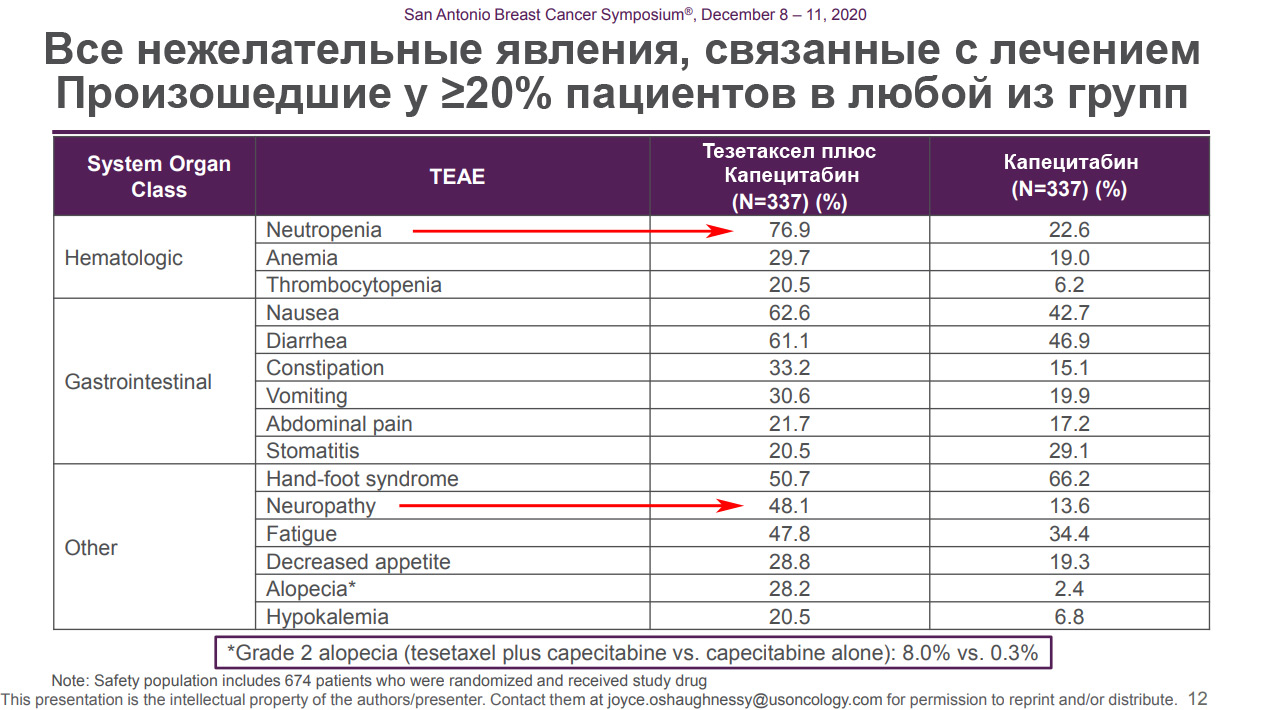
А вот конкретно нейтропения 3-й и 4-й степени возникла у 71% пациентов (32,6 + 38,3 = 70,9)
Кевин Танг, вероятно, оценивал, что польза лекарства превышает негативные последствия и поэтому докупал бумаги.
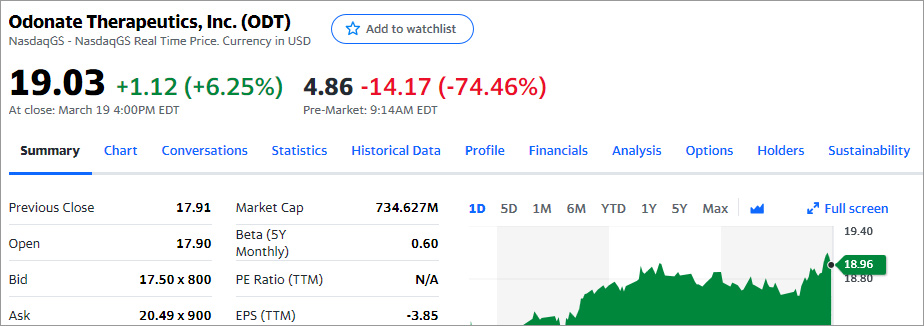
В понедельник, 22 марта 2021 года перед началом торгов выходит новость: «Odonate Therapeutics Announces Discontinuation of Development of Tesetaxel» (Компания Odonate Therapeutics объявила о прекращении разработки препарата Tesetaxel)
https://www.businesswire.com/news/home/20210322005211/en/Odonate-Therapeutics-Announces-Discontinuation-of-Development-of-Tesetaxel
Машинный перевод новости
На премаркете цена акций обвалилась в 4 раза
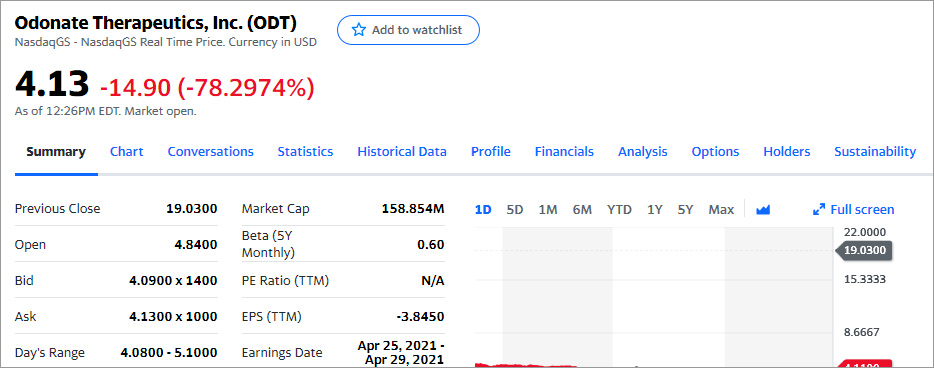
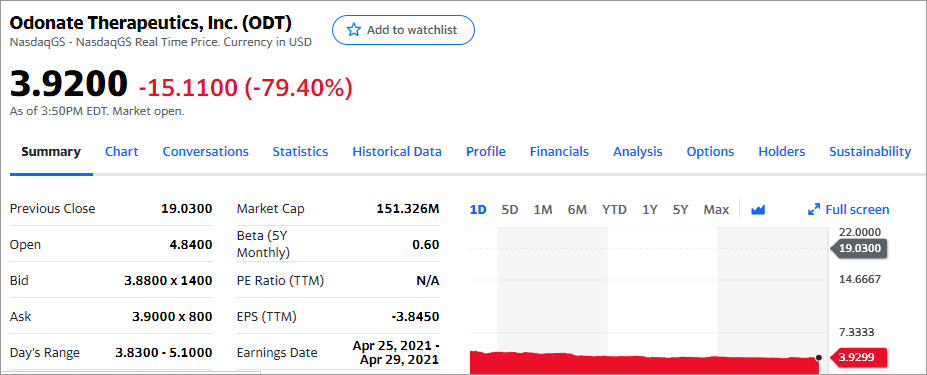
Во время основной сессии торгов цена упала ещё ниже:
Инсайдеры продали свои бумаги лишь в ноябре 2021 года
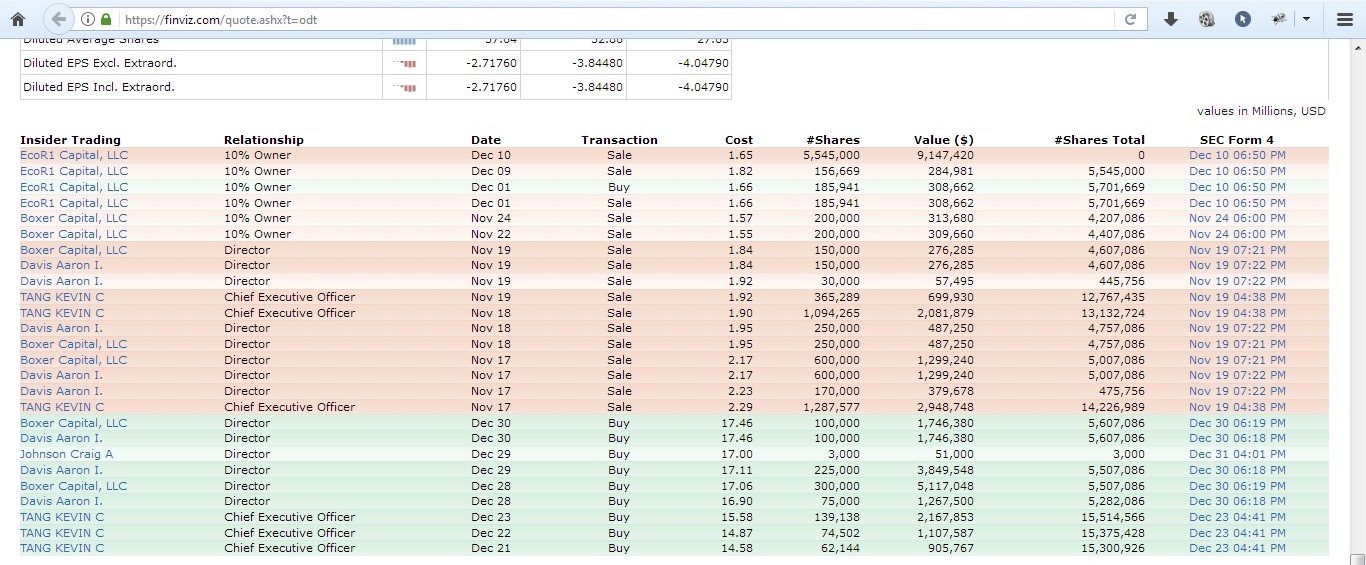
6 января 2022 года компания получила от биржи NASDAQ письмо о несоответствии правилам биржи и уже 18 января торги акциями были остановлены.
На этом история Odonate Therapeutics закончилась
Odonate Therapeutics является хорошим примером того, что нельзя слепо доверяться покупкам инсайдеров, даже когда они наращивают мажоритарную долю. Но обо всём по порядку.

Компания Odonate Therapeutics занималась клиническим исследованием препарата Тезетаксел (Tesetaxel) для лечения метастатического рака молочной железы.
Вот что писала компания в своём отчёте 10-K за 2020 год:
Оригинальный текст
In patients with metastatic breast cancer (“MBC”), tesetaxel was shown to have significant, single-agent antitumor activity in two multicenter, Phase 2 studies. Tesetaxel currently is the subject of three studies in MBC, including a multinational, multicenter, randomized, Phase 3 study in patients with MBC, known as CONTESSA. Positive results of CONTESSA were presented at the 2020 San Antonio Breast Cancer Symposium (“SABCS”). We plan to submit a New Drug Application (“NDA”) for tesetaxel to the U.S. Food and Drug Administration (“FDA”) in mid-2021.
Перевод от Яндекса
В двух многоцентровых исследованиях фазы 2 у пациенток с метастатическим раком молочной железы (“MBC”) было показано, что Тезетаксел обладает значительной противоопухолевой активностью в отношении одного агента. В настоящее время Тезетаксел является предметом трех исследований при MBC, включая многонациональное, многоцентровое, рандомизированное исследование фазы 3 у пациентов с MBC, известное как CONTESSA. Положительные результаты CONTESSA были представлены на симпозиуме по раку молочной железы в Сан-Антонио в 2020 году (“SABCS”). Мы планируем подать новую заявку на лекарственное средство (“NDA”) для Тезетаксела в Управление по контролю за продуктами и лекарствами США (“FDA”) в середине 2021 года
Строго говоря, что пишет компания к действительности не всегда имеет отношение, так как подчёркиваются и выделяются только положительные моменты, а о негативных сторонах дела умалчивается или завуалируется, что может приводить к потери капитала доверившегося читателя.
Посмотрим на анонс результатов исследования CONTESSA, опубликованные 24 августа 2020 года и которые организация характеризует как положительные:
https://www.businesswire.com/news/home/20200824005197/en/Odonate-Therapeutics-Announces-Positive-Top-line-Results-from-CONTESSA-a-Phase-3-Study-of-Tesetaxel-in-Patients-with-Metastatic-Breast-Cancer
Перевод от Яндекса
САН-ДИЕГО--(ДЕЛОВОЙ ВЕСТНИК)--Odonate Therapeutics, Inc. (NASDAQ: ODT), фармацевтическая компания, занимающаяся разработкой лучших в своем классе терапевтических средств, улучшающих и продлевающих жизнь онкологических пациентов, сегодня объявила о положительных результатах CONTESSA, исследования 3-й фазы применения Тезетаксела у пациентов с метастатическим раком молочной железы (MBC).
CONTESSA - это многонациональное, многоцентровое, рандомизированное исследование фазы 3 Тезетаксела, исследуемого перорального таксана, у пациентов с MBC. Компания CONTESSA сравнивает пероральную дозу Тезетаксела в дозе 27 мг/м2 в первый день каждого 21-дневного цикла плюс сниженную дозу капецитабина (1650 мг/м2/сут перорально в течение 14 дней каждого 21-дневного цикла) с утвержденной дозой только капецитабина (2500 мг/м2/сут дозируется перорально в течение 14 дней каждого 21-дневного цикла) у 685 пациентов, рандомизированных в соотношении 1:1 с отрицательным рецептором 2 эпидермального фактора роста человека (HER2), положительным рецептором гормона (HR) MBC, ранее получавших таксан в неоадъювантной или вспомогательной терапии. Капецитабин - это пероральный химиотерапевтический препарат, который считается стандартом лечения при MBC. При наличии показаний пациенты должны получать эндокринную терапию с ингибитором циклинзависимой киназы (CDK) 4/6 или без него. Первичной конечной точкой является выживаемость без прогрессирования заболевания (PFS), оцененная Независимым комитетом по радиологическому обзору (IRC). Вторичными конечными точками эффективности являются общая выживаемость (OS), частота объективного ответа (ORR) по оценке IRC и частота контроля заболевания (DCR) по оценке IRC. Исследование CONTESSA проводится в 180 исследовательских центрах в 18 странах Северной Америки, Европы и Азии.
CONTESSA достигла основной конечной точки улучшения PFS, согласно оценке IRC. Медиана PFS составила 9,8 месяцев при приеме Тезетаксела плюс сниженной дозы капецитабина по сравнению с 6,9 месяцами при приеме только одобренной дозы капецитабина, улучшение на 2,9 месяца. Риск прогрессирования заболевания или смерти был снижен на 28,4% [отношение рисков=0,716 (95% доверительный интервал: 0,573-0,895); р=0,003] при применении Тезетаксела в сочетании с уменьшенной дозой капецитабина по сравнению с одобренной дозой только капецитабина.
Применение Тезетаксела в сочетании с капецитабином ассоциировалось с управляемым профилем побочных эффектов, что соответствовало результатам предыдущих клинических исследований. Побочными эффектами, возникшими при лечении ≥3 степени (TEAE), которые наблюдались у ≥5% пациентов, были: нейтропения (71,2% при применении Тезетаксела плюс капецитабин против 8,3% при применении только капецитабина); диарея (13,4% при применении Тезетаксела плюс капецитабин против 8,9% при применении только капецитабина); синдром "рука-нога" (6,8% для Тезетаксела плюс капецитабин против 12,2% для одного капецитабина); фебрильная нейтропения (12,8% для Тезетаксела плюс капецитабин против 1,2% для одного капецитабина).; утомляемость (8,6% для Тезетаксела плюс капецитабин против 4,5% для одного капецитабина); гипокалиемия (8,6% для Тезетаксела плюс капецитабин против 2,7% для одного капецитабина); лейкопения (10,1% для Тезетаксела плюс капецитабин против 0,9% для одного капецитабина); и анемия (8,0% для Тезетаксела плюс капецитабин против 2,1% для одного капецитабина). только для капецитабина).
Нежелательными явлениями, приведшими к прекращению лечения у ≥1% пациентов, были: нейтропения или фебрильная нейтропения (4,2% при применении Тезетаксела плюс капецитабин против 1,5% при применении только капецитабина); невропатия (3,6% при применении Тезетаксела плюс капецитабин против 0,3% при применении только капецитабина); диарея (0,9% при применении Тезетаксела плюс капецитабин против 1,5% при применении только капецитабина). для одного капецитабина); и синдром кистей и стоп (0,6% для Тезетаксела плюс капецитабин против 2,1% для одного капецитабина). Прекращение лечения из-за любого нежелательного явления произошло у 23,1% пациентов, получавших Тезетаксел плюс капецитабин, по сравнению с 11,9% пациентов, получавших только капецитабин.
Алопеция 2 степени (выпадение волос) наблюдалась у 8,0% пациентов, получавших Тезетаксел плюс капецитабин, по сравнению с 0,3% пациентов, получавших только капецитабин. Нейропатия ≥3 степени наблюдалась у 5,9% пациентов, получавших Тезетаксел плюс капецитабин, по сравнению с 0,9% пациентов, получавших только капецитабин.
Хотя данные об общей выживаемости (ОВ) еще не готовы, недавний промежуточный анализ показал отсутствие неблагоприятного воздействия на ОВ. Ожидается, что окончательный анализ ОС будет проведен в 2022 году.
CONTESSA - это многонациональное, многоцентровое, рандомизированное исследование фазы 3 Тезетаксела, исследуемого перорального таксана, у пациентов с MBC. Компания CONTESSA сравнивает пероральную дозу Тезетаксела в дозе 27 мг/м2 в первый день каждого 21-дневного цикла плюс сниженную дозу капецитабина (1650 мг/м2/сут перорально в течение 14 дней каждого 21-дневного цикла) с утвержденной дозой только капецитабина (2500 мг/м2/сут дозируется перорально в течение 14 дней каждого 21-дневного цикла) у 685 пациентов, рандомизированных в соотношении 1:1 с отрицательным рецептором 2 эпидермального фактора роста человека (HER2), положительным рецептором гормона (HR) MBC, ранее получавших таксан в неоадъювантной или вспомогательной терапии. Капецитабин - это пероральный химиотерапевтический препарат, который считается стандартом лечения при MBC. При наличии показаний пациенты должны получать эндокринную терапию с ингибитором циклинзависимой киназы (CDK) 4/6 или без него. Первичной конечной точкой является выживаемость без прогрессирования заболевания (PFS), оцененная Независимым комитетом по радиологическому обзору (IRC). Вторичными конечными точками эффективности являются общая выживаемость (OS), частота объективного ответа (ORR) по оценке IRC и частота контроля заболевания (DCR) по оценке IRC. Исследование CONTESSA проводится в 180 исследовательских центрах в 18 странах Северной Америки, Европы и Азии.
CONTESSA достигла основной конечной точки улучшения PFS, согласно оценке IRC. Медиана PFS составила 9,8 месяцев при приеме Тезетаксела плюс сниженной дозы капецитабина по сравнению с 6,9 месяцами при приеме только одобренной дозы капецитабина, улучшение на 2,9 месяца. Риск прогрессирования заболевания или смерти был снижен на 28,4% [отношение рисков=0,716 (95% доверительный интервал: 0,573-0,895); р=0,003] при применении Тезетаксела в сочетании с уменьшенной дозой капецитабина по сравнению с одобренной дозой только капецитабина.
Применение Тезетаксела в сочетании с капецитабином ассоциировалось с управляемым профилем побочных эффектов, что соответствовало результатам предыдущих клинических исследований. Побочными эффектами, возникшими при лечении ≥3 степени (TEAE), которые наблюдались у ≥5% пациентов, были: нейтропения (71,2% при применении Тезетаксела плюс капецитабин против 8,3% при применении только капецитабина); диарея (13,4% при применении Тезетаксела плюс капецитабин против 8,9% при применении только капецитабина); синдром "рука-нога" (6,8% для Тезетаксела плюс капецитабин против 12,2% для одного капецитабина); фебрильная нейтропения (12,8% для Тезетаксела плюс капецитабин против 1,2% для одного капецитабина).; утомляемость (8,6% для Тезетаксела плюс капецитабин против 4,5% для одного капецитабина); гипокалиемия (8,6% для Тезетаксела плюс капецитабин против 2,7% для одного капецитабина); лейкопения (10,1% для Тезетаксела плюс капецитабин против 0,9% для одного капецитабина); и анемия (8,0% для Тезетаксела плюс капецитабин против 2,1% для одного капецитабина). только для капецитабина).
Нежелательными явлениями, приведшими к прекращению лечения у ≥1% пациентов, были: нейтропения или фебрильная нейтропения (4,2% при применении Тезетаксела плюс капецитабин против 1,5% при применении только капецитабина); невропатия (3,6% при применении Тезетаксела плюс капецитабин против 0,3% при применении только капецитабина); диарея (0,9% при применении Тезетаксела плюс капецитабин против 1,5% при применении только капецитабина). для одного капецитабина); и синдром кистей и стоп (0,6% для Тезетаксела плюс капецитабин против 2,1% для одного капецитабина). Прекращение лечения из-за любого нежелательного явления произошло у 23,1% пациентов, получавших Тезетаксел плюс капецитабин, по сравнению с 11,9% пациентов, получавших только капецитабин.
Алопеция 2 степени (выпадение волос) наблюдалась у 8,0% пациентов, получавших Тезетаксел плюс капецитабин, по сравнению с 0,3% пациентов, получавших только капецитабин. Нейропатия ≥3 степени наблюдалась у 5,9% пациентов, получавших Тезетаксел плюс капецитабин, по сравнению с 0,9% пациентов, получавших только капецитабин.
Хотя данные об общей выживаемости (ОВ) еще не готовы, недавний промежуточный анализ показал отсутствие неблагоприятного воздействия на ОВ. Ожидается, что окончательный анализ ОС будет проведен в 2022 году.
Особый кусок из оригинала новости
Tesetaxel plus capecitabine was associated with a manageable side effect profile consistent with findings from previous clinical studies. Grade ≥3 treatment-emergent adverse events (TEAEs) that occurred in ≥5% of patients were: neutropenia (71.2% for tesetaxel plus capecitabine vs. 8.3% for capecitabine alone); diarrhea (13.4% for tesetaxel plus capecitabine vs. 8.9% for capecitabine alone); hand-foot syndrome (6.8% for tesetaxel plus capecitabine vs. 12.2% for capecitabine alone); febrile neutropenia (12.8% for tesetaxel plus capecitabine vs. 1.2% for capecitabine alone); fatigue (8.6% for tesetaxel plus capecitabine vs. 4.5% for capecitabine alone); hypokalemia (8.6% for tesetaxel plus capecitabine vs. 2.7% for capecitabine alone); leukopenia (10.1% for tesetaxel plus capecitabine vs. 0.9% for capecitabine alone); and anemia (8.0% for tesetaxel plus capecitabine vs. 2.1% for capecitabine alone).
По новости ясно, что препарат показывает эффективность, но есть сильная побочка - нейтропения 3 и 4-й степени (>=3), возникающая у 71% пациентов и на 60% чаще, чем у другого сравниваемого и одобренного препарата - Капецитабина.
Для упрощения я вставлю кусок короткого, но ёмкого по сути описания нейтропении с сайта
https://oncoguide.ru/poleznye-materialy/309-nejtropeniya-prichiny-profilaktika-opasnost/
Нейтропения — это термин, определяющий снижение числа нейтрофилов. Нейтрофилы — это разновидность белых клеток крови, которые отвечают, в том числе, и за защиту организма от инфекционных агентов. Снижение их количества ниже определенного порога называется нейтропенией. В норме считается, что их должно быть 2000. Когда они снижаются до 1500 и ниже, это не опасно, но это уже нейтропения второй степени тяжести. Когда их число становится меньше 1000, это нейтропения третьей степени тяжести. Все, что ниже 1500, не позволяет в большинстве случаев проводить очередной курс лекарственного цитостатического лечения. Снижение числа нейтрофилов до 500 клеток и менее — то, что трактуется врачом как нейтропения четвертой степени тяжести, и может стать состоянием, которое несет угрозу уже не столько для продолжения лечения, но в том числе представляет непосредственную угрозу жизни пациента и требует очень серьезных и быстрых дополнительных медицинских вмешательств. Если пациент слышит, что у него нейтропения 3 степени тяжести, это однозначный факт, что лечение необходимо прервать.
На новости 24 августа 2020 года с информацией о положительных результатах исследования и наличии чувствительной побочки в виде нейтропении рынок отреагировал отрицательно, бумага упала на 45%

Теперь подходим к инсайдерам. У компании по сведениям из отчёта 10-К за 2019 год был крупный мажоритарий - Кевин Танг (Kevin Tang), владеющий 46% акций. Кевин через свой фонд Tang Capital Management LLC не первый год участвует в жизни биотехнических компаний и поэтому очевидно, что это не случайный человек и имеет значительный опыт. Более того, Кевин в качестве зарплаты назначил себе 1$.

Даже после результатов фазы 3, когда бумага растеряла 50% своей цены Кевин Танг докупал бумаги на чувствительные объёмы

В период с 8 по 11 декабря 2020 года в Сан-Антонио (США) проводилась конференция по раку молочной железы, на которой Odonate Therapeutics представила более полные результаты третьей фазы клинического испытания Тезетаксела и опубликовала презентацию (скачать презентацию — PDF, 673 Кб).
Нам больше всего интересны слайды с нежелательными явлениями (побочками), возникшими при приёме лекарства
В презентации 76% случаев нейтропении относятся ко всем степеням тяжести

А вот конкретно нейтропения 3-й и 4-й степени возникла у 71% пациентов (32,6 + 38,3 = 70,9)

Кевин Танг, вероятно, оценивал, что польза лекарства превышает негативные последствия и поэтому докупал бумаги.
В понедельник, 22 марта 2021 года перед началом торгов выходит новость: «Odonate Therapeutics Announces Discontinuation of Development of Tesetaxel» (Компания Odonate Therapeutics объявила о прекращении разработки препарата Tesetaxel)
https://www.businesswire.com/news/home/20210322005211/en/Odonate-Therapeutics-Announces-Discontinuation-of-Development-of-Tesetaxel
Машинный перевод новости
После того как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) провело совещание, предшествующее подаче заявки на новый препарат, компания Odonate Therapeutics, Inc. (NASDAQ: ODT) пришла к выводу, что пакет клинических данных по тезетакселу вряд ли будет способствовать одобрению препарата FDA. Поэтому компания Odonate прекращает разработку Тезетаксела и сворачивает свою деятельность. Компания будет работать с клиническими базами, чтобы перевести пациентов, участвующих в продолжающихся клинических исследованиях тезетаксела, на соответствующую альтернативную терапию.
"Мы благодарим исследователей, персонал исследовательских групп, а также пациентов и их близких за их усилия, направленные на улучшение лечения больных раком молочной железы", - сказал Кевин Танг, генеральный директор компании Odonate.
"Мы благодарим исследователей, персонал исследовательских групп, а также пациентов и их близких за их усилия, направленные на улучшение лечения больных раком молочной железы", - сказал Кевин Танг, генеральный директор компании Odonate.
На премаркете цена акций обвалилась в 4 раза

Во время основной сессии торгов цена упала ещё ниже:


Инсайдеры продали свои бумаги лишь в ноябре 2021 года

6 января 2022 года компания получила от биржи NASDAQ письмо о несоответствии правилам биржи и уже 18 января торги акциями были остановлены.
На этом история Odonate Therapeutics закончилась